Chi si occupa di valutazioni del rischio esplosione (Atex) sa benissimo che tutti i vapori dei liquidi infiammabili (Acetone, Alcool, Toluene, ecc.) sono più pesanti dell’aria, di conseguenza, tenderanno a stratificare in basso saturando tombini, fosse e vasche di contenimento. Come dire che i liquidi infiammabili “evaporano” ma i vapori scivolano in basso. Esistono anche alcuni gas con questa caratteristica come per esempio il GPL.
Per determinare le densità dei vapori o dei gas si passa attraverso la definizione di Massa Molare M. La massa molare M di un composto rappresenta la massa in grammi di una mole; essa coincide numericamente con il valore della massa molecolare (o eventualmente con la massa atomica) ma la sua unità di misura è g/mol.
Nella tabella seguente si riportano alcuni valori di massa molare approssimati dei composti più comuni.
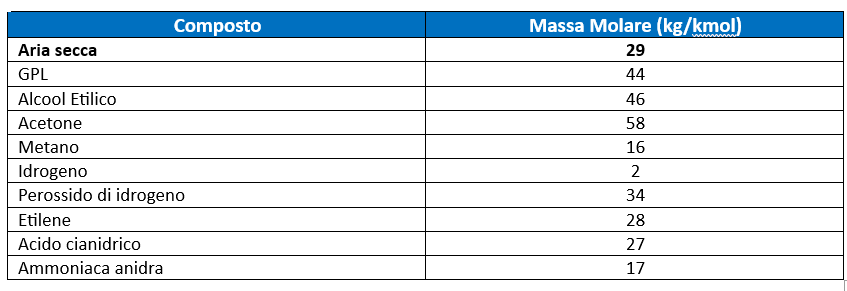
Quindi in generale tutti i vapori o gas che hanno una massa molare maggiore dell’aria (29 kg/kmol) tenderanno a stratificare in basso mentre quelli con massa molare inferiore a 29 kg/kmol tenderanno a migrare verso l’alto. Partendo dalla massa molare è possibile calcolare la densità dei vapori con la seguente formula:
Densità (kg/m3) = Pa x M / R x Ta
Dove:
- Pa = Pressione ambiente in Pascal (1 atmosfera = 101325 Pa).
- M = Massa Molare in kg/kmol.
- R = 8314 J/mol K
- Ta = temperatura ambiente in gradi Kelvin (1° K = - 272,15 °C)
Per esempio, nella tabella seguente vengono riportate le densità a 25 °C dei composti visti in precedenza.
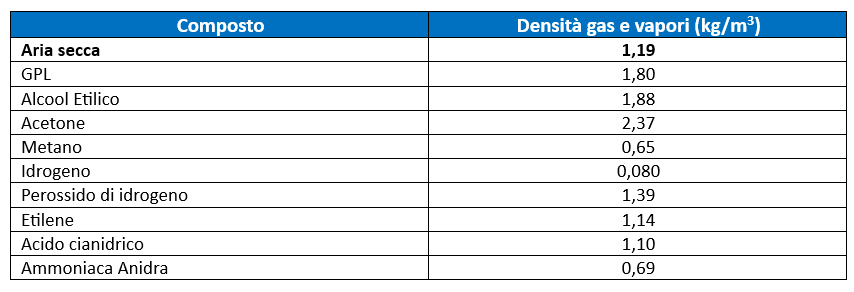
Nella formula del calcolo della densità la temperatura ambiente Ta è a denominatore questo vuol dire che la densità ha un andamento iperbolico in funzione della temperatura. Occorre ricordarsi che la temperatura è in gradi Kelvin, di conseguenza, la densità non diverge mai, anzi, varia molto lentamente in funzione della temperatura.
Implicazioni relativamente alla sicurezza
- Tutti i vapori sono più pesanti dell’aria e stratificano in basso, molto in basso e li rimangono per tempi infiniti.
- Un fusto industriale con un residuo di solvente infiammabile è molto pericoloso se si va a saldare o tagliare con la fiamma acetilene perché i vapori rimangono all’interno.
- Bonificare un fusto è una questione molto delicata, occorre capovolgerlo e fare uscire i vapori in ambiente aperto o ancora meglio prelevare i vapori con un impianto di aspirazione Atex. L’utilizzare l’acqua non è sempre una bella idea perché la maggior parte dei solventi organici non si diluiscono in acqua (benzina).
- Quando si utilizzano solventi organici (Acetone, Alcool, Toluene, ecc.) per operazioni di pulizia anche lieve bisogna sempre chiedersi dove vanno a finire i vapori. Siccome vanno a finire in basso occorre fare attenzione a tombini, fosse, avvallamenti e vasche di contenimento.
- Le aperture di ventilazione collocate in alto degli armadi certificati per liquidi infiammabili non servono a nulla, le aperture vanno fatte in basso.
- Le cappe di aspirazione con la presa in alto sono inutili a meno che ci sia una velocità dell’aria almeno pari a circa 0,5 m/s nel punto di produzione dei vapori.
- Piccole quantità di liquido infiammabile possono già creare atmosfere potenzialmente esplosive. In un bidone da 200 litri bastano per esempio: 7 g benzina, 10 g di nitro diluente, 10 g di toluolo, 11 g di acetone; queste quantità sono paragonabili a 1 o 2 cucchiai di liquido.
